Fabrication de soude et de potasse (hydroxyde)
3 participants
Olduvaï :: Faire face aux situations de crise (réservé aux membres s'étant présentés) :: Artisanat (fabriquer soi-même) :: Artisanat divers
Page 1 sur 1
 Fabrication de soude et de potasse (hydroxyde)
Fabrication de soude et de potasse (hydroxyde)
Salut à tous !
Comme un membre a dévoilé la recette dans la zone d'embarquement, je souhaite partager ici mon article qui était disponible par MP, afin de sécuriser un peu l'opération (neutraliser le dichlore en particulier).
Je rappelle que cette expérience n'est pas dénuée de risques, qui peuvent en cas de mauvaise manip sérieusement atteindre la santé.
Ni moi ni le forum ne pourrons être tenus pour responsables des dommages créés ou subis.
J'ai reçu de nombreux MP au sujet de la fabrication des accumulateurs Nickel/Fer.
La question qui revient le plus souvent concerne l'obtention d'hydroxyde de potassium (ou sodium), appelé potasse (resp. soude) LLBSV.
Bien que ce produit est courant en droguerie/supermarché, on peut effectivement se poser la question d'approvisionnement dans le cadre de la construction de ces accus LLBSV.
Dans ce post, je vais décrire une méthode complètement artisanale de fabrication hydroxyde de sodium/potassium.
Ce composé avait été remplacé par de l'hydroxyde de sodium pur lors de la fabrication du prototype d'accumulateur Nickel/Fer, mais cela augmentait
légèrement la résistance interne de l'accumulateur.
J'aurais souhaité proposer la fabrication d'hydroxyde de potassium pur, afin d'avoir un électrolyte authentique, mais je n'ai toujours pas réussi à
trouver du chlorure de potassium. Ce dernier n'est rien d'autre que du sel; le même que l'on utilise en remplacement du chlorure de sodium dans
les régimes pauvres en sodium.
Une des voies envisagées serait le carbonate de potassium, assez connu, aussi bien pour les bodybuilders que les extincteurs
Idéalement, on pourrait trouver du KCl en Alsace (mines de potasse), mais aucun fabricant, aucune pharmacie n'en fournit aux particuliers. Selon toute vraisemblance, certaines entreprises proposent du KCl pur en tant que sel de déneigement, mais impossible pour moi d'en trouver sous forme pure (car mélangée à des carbonates).
La seule source de potassium que j'aie trouvé, n'est autre que du sel diététique (hypotenseur), assez courant en grande surface :

Il est composé de 2/3 de chlorure de potassium, et de 1/3 de chlorure de sodium pour 2,5€ les 500g.
Avec le chlorure de sodium, il est possible de synthétiser par électrolyse de l'hydroxyde de sodium; outre ses innombrables utilisations, c'est ce qui donne (combinée avec de l'huile) du savon dur.
Avec le chlorure de potassium, de l'hydroxyde de potassium. Ce composé donne aussi du savon, mais plutôt "mou" voire liquide (plutôt pour les shampoings).
Les deux électrolyses étant tout à fait similaires (Na et K ne réagissent pas), j'ai donc opté pour l'utilisation de ce sel de régime pour créer de l'hydroxyde de potassium-sodium (toujours en proportion 2/3 1/3), afin d'obtenir un électrolyte pour nos batteries; en formant un juste compromis de performance entre de la soude pure et de la potasse pure.
Bien entendu, si l'un des deux produit fait défaut, on peut tout à fait se rabattre sur l'autre
Petit laïus sur l'hydroxyde de potassium (KOH) :

Ce composé est horriblement difficile à obtenir sur le marché français. Il ne semble cependant pas illégal, ce que suggèrent de nombreux
sites/blogs/forums, comme en témoigne un internaute :
La légende de la potasse interdite à la vente…
Le procédé est relativement simple à mettre en œuvre. En fait, il suit quasiment du début à la fin le même processus que notre électrolyse de saumure que nous avions réalisée dans le topic Purification / Désinfection de l'eau par Electrolyse : synthèse d'hypochlorite à ceci près que nous utiliserons de la potasse, et séparerons les électrodes pour permettre le dégagement du dichlore (attention !).
[quote]La réaction globale de l’électrolyse :
À la cathode se déroule la réduction de l’eau :
2H2O + 2e- => 2OH- + H2 (notre hydroxyde)
À l’anode se déroule l’oxydation des ions chlorure :
2Cl- => Cl2 + 2e-
(en plus de la 2H2O => O2 + 4H + 4e-)
L’équation globale correspondante est :
2Cl- + 2H2O => 2OH- + H2 + Cl2
On remarque en particulier que Na et K n'interviennent pas dans la réaction !
Cette fois-ci, l’électrolyse est effectuée de manière à ce que les produits formés soient séparés, le dichlore (Cl2), au lieu de réagir avec l'hydroxyde, va se transformer en gaz et être évacué de la solution.
Attention !
->Le dichlore est extrêmement toxique et suffocant<-.
IL EST VITAL de réaliser cette expérience sous hotte ventilée. Je ne suis pas responsable de tout dommage occasionné pour vous, votre entourage et le reste. Ce topic était disponible uniquement par MP spécialement pour que les débutants ne s'intoxiquent pas en faisant n'importe quoi.
On pourrait se la jouer à la rambo en slip avec une casserole dans la cambrousse, mais étant donné le danger représenté par le dichlore de cette expérience, je propose quelques protocoles expérimentaux afin de le neutraliser.
- il peut être mélangé à du dihydrogène pour former du chlorure d'hydrogène (ie acide chlorhydrique) par l'action des ultraviolets de la lumière du jour. Le principal soucis ici étant que le dichlore est mélangé au dioxygène lors de la réaction, et on sait que O2 + H2 = BOUM...
- on peut le dissoudre dans de l'eau pure: utiliser la variation de solubilité du dichlore dans l'eau en fonction de la température de la solution. (15g.L-1 dans une eau à 0°C celle d'accueil, mais de 5,5g.L-1 à 30°C, celle de l'électrolyse).
On obtient une solution aqueuse appelée "eau de chlore" selon l'équation : CL2 + 2H2O= Cl- + HClO + H3O. Cette eau est verdâtre et a quelques propriétés, mais dégage toujours du dichlore en fonction de sa température.
- Enfin, celui que je vais décrire ici : la synthèse du chlorure de fer III, très utile en chimie, car ce solide absorbe très fortement l'humidité ambiante pour devenir un acide de Lewis, l'un des plus puissants et les plus utilisés en chimie.
A la base, j'avais opté pour la synthèse de chlorure d'aluminium, qui a également de nombreuses propriétés :

Acide de Lewis :
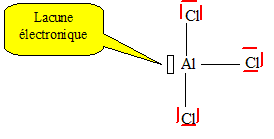
Ce puissant acide (qui se transforme en partie en acide chlorhydrique une fois dissout dans l'eau) peut représenter un certain intérêt LLBSV tant pour l'attaque des métaux que pour la synthèse d'autres molécules, et peut se conserver en bocal de verre sans soucis.
La réaction est relativement simple :
2 Al(solide) + 3 Cl2(gaz) → 2 AlCl3(solide) (via une combustion ou l'action des UVs).
Cependant, le chlorure de Fer III me semble un peu plus intéressant d'un point de vue "LLBSV"
Tout d'abord, certains auront reconnu que nous avons affaire au fameux "perchlorure de fer", le composé qui permet de graver ses propres circuits imprimés !
En effet, il attaque l'acier inoxydable, mais aussi le cuivre :
FeCl3 + Cu → FeCl2 + CuCl suivi de: FeCl3 + CuCl → FeCl2 + CuCl2*
*Je précise que maintenant que la neutralisation du dichlore est opérationnelle, il y a un autre article est disponible par MP sur la celle du CuCL2.
C'est le composé que l'on obtient en gravant des circuits imprimés à l'acide dans le topic Electronique. Il se formera de l'oxyde de cuivre CuO2, qui est entre autres un semi conducteur : fabrication de diodes Schottky de puissance artisanales, de panneaux solaires (faible rendements, comme le montrent les tests sur youtube, mais le principe est là); c'est aussi un puissant fongicide....

2 Fe(s) + 3 Cl2(g) → 2 FeCl3 (s)
On utilise le chlorure de fer III en "traitement" de l'eau :
Enfin, un composé qui pourrait se montrer vraiment intéressant d'un point de vue LLBSV :
wikipedia
Il conviendra cependant de faire de nouveau très attention !
FeCl3 peut provoquer une forte réaction exothermique s'il est mis en contact avec une base ou de l'eau. C'est un réactif à manier avec précautions,
en utilisant des gants et des lunettes de sécurité. Il doit être manipulé sous une hotte. Lorsqu'il est manipulé à l'air humide, le chlorure absorbe rapidement l'humidité pour devenir hautement acide, et il attaque rapidement un grand nombre de matériaux (d'où l'utilisation pour graver les circuits imprimés).
Comme nous souhaitons nous débarrasser du dichlore, nous allons introduire du fer en excès.
Perso, j'ai utilisé de la paille de fer d'une éponge, qui permet une grande surface de contact par gramme, l'idéal serait d'utiliser de la poudre de fer.
Le "neutraliseur de dichlore"
On ne peut plus simple : une éprouvette retournée, contenant au fond de la paille de fer. Au fil de l'expérience, le dichlore remontera dans
l'éprouvette.
L'expérience :
Attention, toute odeur de chlore signale une fuite durant l'expérience. Il convient dans ce cas de stopper immédiatement l'expérience et d'apporter un supplément d'aération.
1 : On sature en sel KNaCl de l'eau distillée.
On mesure le pH de la solution : aux alentours de 6,8
2 : Les électrodes :
comme pour la synthèse de javel, on va utiliser des électrodes de carbone, inertes. Ici, comme on ne les utilisera pas pour la consommation des produits finis, je me suis permis de récupérer deux électrodes de piles salines nettoyées.
La paille de fer est coincée à l'extrémité.

3: L'électrolyse.
Elle démarre avec une tension minimum de 1,36V (potentiel redox Cl2/Cl-). On remarque donc que l'électrolyse de l'eau s'y produit en même temps (d'une tension minimale inférieure).
Ceci, loin d'être un inconvénient, permet quelque-chose d'intéressant : comme nous produisons de l'hydroxyde en continu, mais que nous électrolysons l'eau qui devient deux gaz (dichlore + dioxygène), nous augmentons la concentration de la solution, donc le pH augmente plus vite
En tant que source d'énergie, j'ai utilisé un panneau solaire 2,5V qui débite 270mA à travers notre solution.
Cependant, on peut tout aussi bien utiliser des piles, accus, ou un chargeur de portable. Attention dans ce dernier cas : il convient de connaître la
résistance de la solution à l'ohmmètre afin de ne pas dépasser l'intensité maxi débitée par le générateur.

Il est absolument nécessaire de séparer les électrodes, sans quoi les ions Cl- pourront migrer et nous aurons de la javel au lieu de la soude !
Une membrane DIY peut être faite avec une plaque de polystyrène (celle avec des "grains").
La membrane est poreuse, mais les solutions ne se mélangent pas (excessivement peu). S'il n'y a pas la membrane, les ions chlore finissent par migrer jusqu'à l'autre électrode (même si elle est à plus de 10cm), et on a de la javel.
La membrane stoppe ces transferts d'ions sans pour autant séparer électriquement les solutions; l'eau s'infiltre dans "les grains".
C'est très DIY (on a beaucoup mieux), mais lors des tests de pH, il n'y avait pas de trace d'hydroxyde dans la solution de droite (cela doit se mesurer en ppm), donc le fonctionnement était plus que satisfaisant.
A l'aide de la "pompe", nous allons aspirer l'eau à l'intérieur de l'éprouvette, afin de minimiser la présence de dioxygène :

Une électrolyse poussée de notre solution va conduire à une diminution de la quantité d'eau en solution (les gaz H2 et O2 s'échappant), et cela va donc augmenter la concentration finale de notre solution.

(panneau solaire DIY qui sera prochainement décrit )
)
Test de pH au bout de 10 minutes : nos deux solutions ne se sont pas mélangées. Celle de gauche est de la soude, dont le pH est voisin de 14 ! Tandis qu'à droit, il n'y a pas la moindre présence d'hydroxyde : papier non coloré.

Notre Mélange concentré soude/potasse mis en flacon

4: La purification
Le dichlore se produit, et forme un gaz dans le haut de l'éprouvette. On remarque les parties vertes : c'est du chlorure de fer II.

Partie la plus difficile, à faire sous hotte, ne pas respirer les fuites : il faut faire brûler notre fer dans le dichlore. Pour cela on approche une longue allumette de notre paille. Cela rougit. On rebouche soigneusement l'éprouvette et on attend.
On peut néanmoins entièrement sécuriser cette étape en exposant simplement notre éprouvette avec un bouchon au soleil pendant plusieurs jours. La réaction (en parallèle du chlorure II) est censée se produire sous le rayonnement UV : pas de fuites, pas de danger

Il s'est formé notre chlorure de fer III. Ce dernier s'est immédiatement combiné à l'humidité du tube, et forme du perchlorure hydraté (prêt pour
une gravure).
Bons bidouillages à tous...et prudence !
Comme un membre a dévoilé la recette dans la zone d'embarquement, je souhaite partager ici mon article qui était disponible par MP, afin de sécuriser un peu l'opération (neutraliser le dichlore en particulier).
Je rappelle que cette expérience n'est pas dénuée de risques, qui peuvent en cas de mauvaise manip sérieusement atteindre la santé.
Ni moi ni le forum ne pourrons être tenus pour responsables des dommages créés ou subis.
J'ai reçu de nombreux MP au sujet de la fabrication des accumulateurs Nickel/Fer.
La question qui revient le plus souvent concerne l'obtention d'hydroxyde de potassium (ou sodium), appelé potasse (resp. soude) LLBSV.
Bien que ce produit est courant en droguerie/supermarché, on peut effectivement se poser la question d'approvisionnement dans le cadre de la construction de ces accus LLBSV.
Dans ce post, je vais décrire une méthode complètement artisanale de fabrication hydroxyde de sodium/potassium.
Ce composé avait été remplacé par de l'hydroxyde de sodium pur lors de la fabrication du prototype d'accumulateur Nickel/Fer, mais cela augmentait
légèrement la résistance interne de l'accumulateur.
J'aurais souhaité proposer la fabrication d'hydroxyde de potassium pur, afin d'avoir un électrolyte authentique, mais je n'ai toujours pas réussi à
trouver du chlorure de potassium. Ce dernier n'est rien d'autre que du sel; le même que l'on utilise en remplacement du chlorure de sodium dans
les régimes pauvres en sodium.
Une des voies envisagées serait le carbonate de potassium, assez connu, aussi bien pour les bodybuilders que les extincteurs

Idéalement, on pourrait trouver du KCl en Alsace (mines de potasse), mais aucun fabricant, aucune pharmacie n'en fournit aux particuliers. Selon toute vraisemblance, certaines entreprises proposent du KCl pur en tant que sel de déneigement, mais impossible pour moi d'en trouver sous forme pure (car mélangée à des carbonates).
La seule source de potassium que j'aie trouvé, n'est autre que du sel diététique (hypotenseur), assez courant en grande surface :

Il est composé de 2/3 de chlorure de potassium, et de 1/3 de chlorure de sodium pour 2,5€ les 500g.
Avec le chlorure de sodium, il est possible de synthétiser par électrolyse de l'hydroxyde de sodium; outre ses innombrables utilisations, c'est ce qui donne (combinée avec de l'huile) du savon dur.
Avec le chlorure de potassium, de l'hydroxyde de potassium. Ce composé donne aussi du savon, mais plutôt "mou" voire liquide (plutôt pour les shampoings).
Les deux électrolyses étant tout à fait similaires (Na et K ne réagissent pas), j'ai donc opté pour l'utilisation de ce sel de régime pour créer de l'hydroxyde de potassium-sodium (toujours en proportion 2/3 1/3), afin d'obtenir un électrolyte pour nos batteries; en formant un juste compromis de performance entre de la soude pure et de la potasse pure.
Bien entendu, si l'un des deux produit fait défaut, on peut tout à fait se rabattre sur l'autre

Petit laïus sur l'hydroxyde de potassium (KOH) :

Ce composé est horriblement difficile à obtenir sur le marché français. Il ne semble cependant pas illégal, ce que suggèrent de nombreux
sites/blogs/forums, comme en témoigne un internaute :
La légende de la potasse interdite à la vente…
...je vérifie par habitude et curiosité les textes de loi. Et là surprise, aucune mention sur la potasse ! Je continue donc mes recherches et découvre que certains produits sont interdits à la vente aux particuliers, d’autres à l’envoi postal au vue de leur dangerosité ou instabilité chimique. Mais nulle part il n’est fait mention de potasse caustique.
Le procédé est relativement simple à mettre en œuvre. En fait, il suit quasiment du début à la fin le même processus que notre électrolyse de saumure que nous avions réalisée dans le topic Purification / Désinfection de l'eau par Electrolyse : synthèse d'hypochlorite à ceci près que nous utiliserons de la potasse, et séparerons les électrodes pour permettre le dégagement du dichlore (attention !).
[quote]La réaction globale de l’électrolyse :
À la cathode se déroule la réduction de l’eau :
2H2O + 2e- => 2OH- + H2 (notre hydroxyde)
À l’anode se déroule l’oxydation des ions chlorure :
2Cl- => Cl2 + 2e-
(en plus de la 2H2O => O2 + 4H + 4e-)
L’équation globale correspondante est :
2Cl- + 2H2O => 2OH- + H2 + Cl2
On remarque en particulier que Na et K n'interviennent pas dans la réaction !
Cette fois-ci, l’électrolyse est effectuée de manière à ce que les produits formés soient séparés, le dichlore (Cl2), au lieu de réagir avec l'hydroxyde, va se transformer en gaz et être évacué de la solution.
Attention !
->Le dichlore est extrêmement toxique et suffocant<-.
IL EST VITAL de réaliser cette expérience sous hotte ventilée. Je ne suis pas responsable de tout dommage occasionné pour vous, votre entourage et le reste. Ce topic était disponible uniquement par MP spécialement pour que les débutants ne s'intoxiquent pas en faisant n'importe quoi.
On pourrait se la jouer à la rambo en slip avec une casserole dans la cambrousse, mais étant donné le danger représenté par le dichlore de cette expérience, je propose quelques protocoles expérimentaux afin de le neutraliser.
- il peut être mélangé à du dihydrogène pour former du chlorure d'hydrogène (ie acide chlorhydrique) par l'action des ultraviolets de la lumière du jour. Le principal soucis ici étant que le dichlore est mélangé au dioxygène lors de la réaction, et on sait que O2 + H2 = BOUM...
- on peut le dissoudre dans de l'eau pure: utiliser la variation de solubilité du dichlore dans l'eau en fonction de la température de la solution. (15g.L-1 dans une eau à 0°C celle d'accueil, mais de 5,5g.L-1 à 30°C, celle de l'électrolyse).
On obtient une solution aqueuse appelée "eau de chlore" selon l'équation : CL2 + 2H2O= Cl- + HClO + H3O. Cette eau est verdâtre et a quelques propriétés, mais dégage toujours du dichlore en fonction de sa température.
- Enfin, celui que je vais décrire ici : la synthèse du chlorure de fer III, très utile en chimie, car ce solide absorbe très fortement l'humidité ambiante pour devenir un acide de Lewis, l'un des plus puissants et les plus utilisés en chimie.
A la base, j'avais opté pour la synthèse de chlorure d'aluminium, qui a également de nombreuses propriétés :

AlCl3 est probablement l'acide de Lewis le plus couramment utilisé et parmi les plus puissants. Ce composé possède de très nombreuses applications dans l'industrie chimique, notamment comme catalyseur pour les réactions de Friedel et Crafts, à la fois l'alkylation et l'acylation. Il est également utilisé pour des réactions de polymérisation ou d'isomérisation de composés organiques
Acide de Lewis :

Ce puissant acide (qui se transforme en partie en acide chlorhydrique une fois dissout dans l'eau) peut représenter un certain intérêt LLBSV tant pour l'attaque des métaux que pour la synthèse d'autres molécules, et peut se conserver en bocal de verre sans soucis.
La réaction est relativement simple :
2 Al(solide) + 3 Cl2(gaz) → 2 AlCl3(solide) (via une combustion ou l'action des UVs).
Cependant, le chlorure de Fer III me semble un peu plus intéressant d'un point de vue "LLBSV"

Tout d'abord, certains auront reconnu que nous avons affaire au fameux "perchlorure de fer", le composé qui permet de graver ses propres circuits imprimés !
En effet, il attaque l'acier inoxydable, mais aussi le cuivre :
FeCl3 + Cu → FeCl2 + CuCl suivi de: FeCl3 + CuCl → FeCl2 + CuCl2*
*Je précise que maintenant que la neutralisation du dichlore est opérationnelle, il y a un autre article est disponible par MP sur la celle du CuCL2.
C'est le composé que l'on obtient en gravant des circuits imprimés à l'acide dans le topic Electronique. Il se formera de l'oxyde de cuivre CuO2, qui est entre autres un semi conducteur : fabrication de diodes Schottky de puissance artisanales, de panneaux solaires (faible rendements, comme le montrent les tests sur youtube, mais le principe est là); c'est aussi un puissant fongicide....

2 Fe(s) + 3 Cl2(g) → 2 FeCl3 (s)
On utilise le chlorure de fer III en "traitement" de l'eau :
Le chlorure ferrique est aussi utilisé comme alternative au sulfate de fer(III) pour le traitement de l'eau. Il est alors traité avec un ion hydroxyde pour former un floc d'"hydroxyde de fer(III)" (de formule FeO(OH)) qui permet d'éliminer les particules en suspension.
Enfin, un composé qui pourrait se montrer vraiment intéressant d'un point de vue LLBSV :
wikipedia
Le chlorure ferrique peut également être employé en préparation à usage pharmaceutique externe comme excellent hémostatique en lieu et place de la traditionnelle "eau oxygénée".
Cette préparation qui est relativement peu distribuée se présente sous forme liquide (solution aqueuse) de couleur jaune clair et peut être appliquée
sur des coupures ou petites plaies externes.
Son application au contact du sang provoque immédiatement la formation d'un caillot sanguin de surface ce qui provoque l'hémostase et protège la plaie comme le fait la croute durant le processus de cicatrisation.
Attention, seule une solution de chlorure ferrique dilué à env. 5,2 % est utilisable. (équivalent chlorure ferrique anhydre à 1,5 % env.) Si cette solution est appliquée avec une ouate et que des fibres sont "prises" dans le caillot en formation, ne pas les retirer afin de ne pas rompre la croute ce qui réactiverait le saignement. Ces fibres disparaitront lorsque la croute tombera une fois la plaie cicatrisée.Contrairement à l'eau oxygénée qui est indolore, le chlorure ferrique "pique" mais est très nettement plus efficace en provoquant une coagulation absolument immédiate.
Il conviendra cependant de faire de nouveau très attention !
FeCl3 peut provoquer une forte réaction exothermique s'il est mis en contact avec une base ou de l'eau. C'est un réactif à manier avec précautions,
en utilisant des gants et des lunettes de sécurité. Il doit être manipulé sous une hotte. Lorsqu'il est manipulé à l'air humide, le chlorure absorbe rapidement l'humidité pour devenir hautement acide, et il attaque rapidement un grand nombre de matériaux (d'où l'utilisation pour graver les circuits imprimés).
Comme nous souhaitons nous débarrasser du dichlore, nous allons introduire du fer en excès.
Perso, j'ai utilisé de la paille de fer d'une éponge, qui permet une grande surface de contact par gramme, l'idéal serait d'utiliser de la poudre de fer.
Le "neutraliseur de dichlore"
On ne peut plus simple : une éprouvette retournée, contenant au fond de la paille de fer. Au fil de l'expérience, le dichlore remontera dans
l'éprouvette.
L'expérience :
Attention, toute odeur de chlore signale une fuite durant l'expérience. Il convient dans ce cas de stopper immédiatement l'expérience et d'apporter un supplément d'aération.
1 : On sature en sel KNaCl de l'eau distillée.
On mesure le pH de la solution : aux alentours de 6,8
2 : Les électrodes :
comme pour la synthèse de javel, on va utiliser des électrodes de carbone, inertes. Ici, comme on ne les utilisera pas pour la consommation des produits finis, je me suis permis de récupérer deux électrodes de piles salines nettoyées.
La paille de fer est coincée à l'extrémité.

3: L'électrolyse.
Elle démarre avec une tension minimum de 1,36V (potentiel redox Cl2/Cl-). On remarque donc que l'électrolyse de l'eau s'y produit en même temps (d'une tension minimale inférieure).
Ceci, loin d'être un inconvénient, permet quelque-chose d'intéressant : comme nous produisons de l'hydroxyde en continu, mais que nous électrolysons l'eau qui devient deux gaz (dichlore + dioxygène), nous augmentons la concentration de la solution, donc le pH augmente plus vite

En tant que source d'énergie, j'ai utilisé un panneau solaire 2,5V qui débite 270mA à travers notre solution.
Cependant, on peut tout aussi bien utiliser des piles, accus, ou un chargeur de portable. Attention dans ce dernier cas : il convient de connaître la
résistance de la solution à l'ohmmètre afin de ne pas dépasser l'intensité maxi débitée par le générateur.

Il est absolument nécessaire de séparer les électrodes, sans quoi les ions Cl- pourront migrer et nous aurons de la javel au lieu de la soude !
Une membrane DIY peut être faite avec une plaque de polystyrène (celle avec des "grains").
La membrane est poreuse, mais les solutions ne se mélangent pas (excessivement peu). S'il n'y a pas la membrane, les ions chlore finissent par migrer jusqu'à l'autre électrode (même si elle est à plus de 10cm), et on a de la javel.
La membrane stoppe ces transferts d'ions sans pour autant séparer électriquement les solutions; l'eau s'infiltre dans "les grains".
C'est très DIY (on a beaucoup mieux), mais lors des tests de pH, il n'y avait pas de trace d'hydroxyde dans la solution de droite (cela doit se mesurer en ppm), donc le fonctionnement était plus que satisfaisant.
A l'aide de la "pompe", nous allons aspirer l'eau à l'intérieur de l'éprouvette, afin de minimiser la présence de dioxygène :

Une électrolyse poussée de notre solution va conduire à une diminution de la quantité d'eau en solution (les gaz H2 et O2 s'échappant), et cela va donc augmenter la concentration finale de notre solution.

(panneau solaire DIY qui sera prochainement décrit
 )
)Test de pH au bout de 10 minutes : nos deux solutions ne se sont pas mélangées. Celle de gauche est de la soude, dont le pH est voisin de 14 ! Tandis qu'à droit, il n'y a pas la moindre présence d'hydroxyde : papier non coloré.

Notre Mélange concentré soude/potasse mis en flacon


4: La purification
Le dichlore se produit, et forme un gaz dans le haut de l'éprouvette. On remarque les parties vertes : c'est du chlorure de fer II.

Partie la plus difficile, à faire sous hotte, ne pas respirer les fuites : il faut faire brûler notre fer dans le dichlore. Pour cela on approche une longue allumette de notre paille. Cela rougit. On rebouche soigneusement l'éprouvette et on attend.
On peut néanmoins entièrement sécuriser cette étape en exposant simplement notre éprouvette avec un bouchon au soleil pendant plusieurs jours. La réaction (en parallèle du chlorure II) est censée se produire sous le rayonnement UV : pas de fuites, pas de danger


Il s'est formé notre chlorure de fer III. Ce dernier s'est immédiatement combiné à l'humidité du tube, et forme du perchlorure hydraté (prêt pour
une gravure).
Bons bidouillages à tous...et prudence !

________________________________________________________
L'expérience est une lumière qui n'éclaire que ceux qu'elle a déjà brûlés. Cédric Dassas
甩葱歌 - 古箏 - Distant Pulsar - Un Mauvais Fils - 25 Years of Zelda - Machinarium - Récapitulatif des projets électroniques - [Chroniques du Bunker de L'Apocalypse] - Projet Geiger - Culture ethnobotanique en France

tarsonis- Administrateur
-
 Nombre de messages : 10685
Nombre de messages : 10685
Age : 37
Localisation : Grand Est
Loisirs : Trek, ethnobotanique, électronique DIY, nucléaire, médecine, post apo.
Date d'inscription : 21/05/2008
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
Chapeau!!!!
tu viens de trouver une solution cruciale pour mes projets et je t'en suis très reconnaissant.
petite question: quelle est l'épaisseur minimale du polystyrène ?
tu viens de trouver une solution cruciale pour mes projets et je t'en suis très reconnaissant.
petite question: quelle est l'épaisseur minimale du polystyrène ?
staline- Membre
-
 Nombre de messages : 22
Nombre de messages : 22
Date d'inscription : 05/07/2011
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
Merci !
On peut essayer de diminuer, mais je ne sais pas jusqu'où. De toute façon, si ça filtre, cela va commencer à sentir la javel, et le pH des deux solutions va augmenter. Là, c'est resté inchangé dans le compartiment de droite, avec 13-14 dans l'autre
Ici, j'ai utilisé une plaque de 0,5cm d'épaisseur; soit un peu plus que le diamètre des bulles de polystyrène.staline a écrit:quelle est l'épaisseur minimale du polystyrène ?
On peut essayer de diminuer, mais je ne sais pas jusqu'où. De toute façon, si ça filtre, cela va commencer à sentir la javel, et le pH des deux solutions va augmenter. Là, c'est resté inchangé dans le compartiment de droite, avec 13-14 dans l'autre

________________________________________________________
L'expérience est une lumière qui n'éclaire que ceux qu'elle a déjà brûlés. Cédric Dassas
甩葱歌 - 古箏 - Distant Pulsar - Un Mauvais Fils - 25 Years of Zelda - Machinarium - Récapitulatif des projets électroniques - [Chroniques du Bunker de L'Apocalypse] - Projet Geiger - Culture ethnobotanique en France

tarsonis- Administrateur
-
 Nombre de messages : 10685
Nombre de messages : 10685
Age : 37
Localisation : Grand Est
Loisirs : Trek, ethnobotanique, électronique DIY, nucléaire, médecine, post apo.
Date d'inscription : 21/05/2008
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
merci beaucoup!
j'essaie cela dès que je trouve du polystyrène adéquat
j'essaie cela dès que je trouve du polystyrène adéquat
staline- Membre
-
 Nombre de messages : 22
Nombre de messages : 22
Date d'inscription : 05/07/2011
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
j'ai vu ceci, c'est surtout la membrane qui est intéressante.
https://www.youtube.com/watch?v=m0LADyIfHRs&feature=related
https://www.youtube.com/watch?v=m0LADyIfHRs&feature=related
staline- Membre
-
 Nombre de messages : 22
Nombre de messages : 22
Date d'inscription : 05/07/2011
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
ou alors, une simple éponge dense et compressés ne pourrait-elle pas faire le boulot aussi?
staline- Membre
-
 Nombre de messages : 22
Nombre de messages : 22
Date d'inscription : 05/07/2011
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
Pour la membrane de la vidéo (papier filtre) j'ai des doutes à la fois sur le fait qu'elle empêche les ions de passer (à mon avis elle ralenti simplement le mélange) et sur sa résistance une fois la soude concentrée.
Pour l'éponge, pareil mais il faudrait tester, avec une interrogation pratique en plus: comment comptes-tu la garder "dense et compressée" lors de l'utilisation?
Pour l'éponge, pareil mais il faudrait tester, avec une interrogation pratique en plus: comment comptes-tu la garder "dense et compressée" lors de l'utilisation?
________________________________________________________
(...) car seuls l'art et la science peuvent élever les hommes au niveau des dieux. --Ludwig van Beethoven, 1812

Cyrus_Smith- Membre Premium - Participe à rendre le contenu de nos forums plus pertinent & pragmatique
-
 Nombre de messages : 2252
Nombre de messages : 2252
Localisation : Île mystérieuse
Date d'inscription : 02/09/2011
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
bah pour l'éponge, suffit de l'enfermer entre deux plaques de circuit imprimé dans lesquels on aura découpé l'intérieur pour former un cadre, un peu comme dans la vidéo.
Je dois aller visiter une institution d'enseignement (pour les québécois, un CEGEP) et avec un peu de chance, je pourrai interroger un prof de chimie.
sinon, comme solution efficace et permanente, il reste le nafion (tm) produit par DuPont.
garder les électrodes à bonne distance aide aussi... alors peut-être que des filtres en papier suffisent...
Je dois aller visiter une institution d'enseignement (pour les québécois, un CEGEP) et avec un peu de chance, je pourrai interroger un prof de chimie.
sinon, comme solution efficace et permanente, il reste le nafion (tm) produit par DuPont.
garder les électrodes à bonne distance aide aussi... alors peut-être que des filtres en papier suffisent...
staline- Membre
-
 Nombre de messages : 22
Nombre de messages : 22
Date d'inscription : 05/07/2011
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
Plutôt en perçant des séries de trous dans les plaques de circuit imprimé, non? Si tu découpes un cadre avec un gros trou central, l'éponge va gonfler au milieu et ne restera pas compressée.
Si tu écartes les électrodes, tu augmentes la résistance et ralenti le processus.
Sinon, à titre informatif uniquement car utilisant du mercure (toxique), qui est de toute manière difficilement trouvable en K2KK, il y a le procédé Castner-Kellner (en anglais, rien trouvé en français, sorry) qui a l'avantage de ne plus avoir besoin de membrane.
Si tu écartes les électrodes, tu augmentes la résistance et ralenti le processus.
Sinon, à titre informatif uniquement car utilisant du mercure (toxique), qui est de toute manière difficilement trouvable en K2KK, il y a le procédé Castner-Kellner (en anglais, rien trouvé en français, sorry) qui a l'avantage de ne plus avoir besoin de membrane.

Cyrus_Smith- Membre Premium - Participe à rendre le contenu de nos forums plus pertinent & pragmatique
-
 Nombre de messages : 2252
Nombre de messages : 2252
Localisation : Île mystérieuse
Date d'inscription : 02/09/2011
 Re: Fabrication de soude et de potasse (hydroxyde)
Re: Fabrication de soude et de potasse (hydroxyde)
Cyrus_Smith a écrit:Plutôt en perçant des séries de trous dans les plaques de circuit imprimé, non? Si tu découpes un cadre avec un gros trou central, l'éponge va gonfler au milieu et ne restera pas compressée.
Si tu écartes les électrodes, tu augmentes la résistance et ralenti le processus.
Sinon, à titre informatif uniquement car utilisant du mercure (toxique), qui est de toute manière difficilement trouvable en K2KK, il y a le procédé Castner-Kellner (en anglais, rien trouvé en français, sorry) qui a l'avantage de ne plus avoir besoin de membrane.
Évidemment, c'est pour la filtre en papier, le "cadre"
pour le mercure, j'y ai sérieusement pensé.
D'après ce que j'ai lu, le mercure est récupéré intégralement après chaque production. Avec des individus hyper responsables, car c'est hyper toxique, on peut se stocker en mercure et l'utiliser au besoin.
personnellement, je compte utiliser intensivement l'hydroxyde de sodium dès que possible, cata ou pas. dans les batteries, le savon, faire le biodiésel etc....
Ça pourrait valoir la peine (dans mon cas).
staline- Membre
-
 Nombre de messages : 22
Nombre de messages : 22
Date d'inscription : 05/07/2011
 Sujets similaires
Sujets similaires» Fabriquer le produit miracle: l'hydroxyde de sodium
» Filtrage, cendre de bois et potasse pour lessive.
» Bicarbonate de soude et crampe au ventre
» Fabrication d'un arc
» Fabriquer son savon
» Filtrage, cendre de bois et potasse pour lessive.
» Bicarbonate de soude et crampe au ventre
» Fabrication d'un arc
» Fabriquer son savon
Olduvaï :: Faire face aux situations de crise (réservé aux membres s'étant présentés) :: Artisanat (fabriquer soi-même) :: Artisanat divers
Page 1 sur 1
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum|
|
|








